助教募集のお知らせ
薬理学研究室では助教を募集しています。医学部の研究室だと敷居が高くて応募しにくいと考えているあなた、全くそのようなことはありません。私たちの研究室の助教は工学部の出身です。私は医学部を卒業しましたが、卒後研修を一切せずに研究に飛び込んだためにPhDマインドが非常に強い研究者であると自負しています。研究室の雰囲気も理学部系・工学部系の研究室に近いと感じています。研究室ではみなさん「さん」付けでお互いの名前を呼んでおり、私を「川辺先生」と呼ぶのは一部の学部学生さんだけです。薬理学研究室ではどの学部を卒業したかは全く重要ではありません。
研究に人生をかけてみたいと考えている研究者で、生化学、細胞生物学、分子生物学、神経科学、イメージング、またはプログラミングなどの経験のある方に応募していただければ嬉しいです。これまで神経科学の経験がない方でも、これからやってみたいという意思がある方であれば問題ありません。私や他のスタッフがしっかりと神経科学研究に必要な技術と考え方を教えます。若い方であればそれほど論文や獲得研究費が多くないのは当然です。若い応募者についてはこれまでの実績よりも、どのような技術でどのような研究をしてきたのか、そして何よりいい研究をしたいという熱意が大切だと思います。興味がある方はまず気軽に川辺までメールを送ってください。海外でポスドクとして研究している方や大学院修了直後の方からの連絡も大歓迎です。メールアドレスは kawabe@gunma-u.ac.jp です。
私が長年ドイツの小さな街で研究していたからかもしれませんが、群馬大学の研究環境は最高だと感じています。群馬大学は都会の喧騒から離れていて研究に集中できる環境にあります。物価が安いにも関わらず、東京へのアクセスがしやすいために、快適な生活を送れると思います。先日もドイツから来日していた友人と一緒に、日帰りで豊洲市場に行ってから銀座で買い物を楽しみ、その後に大相撲を国技館で見てきました。
助教に着任していただいた方には、研究者として成長できるように私自らが一生懸命に指導したいと思います。ドイツの私の研究室でも現在の薬理学研究室でも若手の指導には相当に力を入れてきており、若手の指導に成功してきたと思います。薬理学研究室での研究を、いずれは自分の研究へと発展させてもらい、将来の日本の研究を引っ張っていただきたいというのが私の希望です。
お知らせ
-
- 2025.12.19
- ラボ旅行と忘年会でした!
-
- 2025.7.26
- 神経科学会大会(新潟)で六本木さんがシンポジウムで発表しました。
-
- 2025.7.17
- 細胞生物学会(名古屋)で獺ヶ口くんがワークショップで発表しました。
-
- 2025.4.1
- 清水典朗くんが薬理学講座の大学院生として参加してくれました!
-
- 2025.3.1
- 中尾章人さんが准教授として着任してくれました!
-
- 2024.11.14
- 六本木さんが先進医薬研究振興財団の助成金に採択されました!
-
- 2024.11.7
- 医学部医学科5年生の内山さんが第97回日本生化学会大会で発表しました。
-
- 2024.7.31
- 六本木さんが武田科学振興財団の助成金に採択されました!
-
- 2024.6.25
- 六本木さんが薬理研究会の助成金に採択されました!
-
- 2023.10.11
- 小金澤さんが群馬大学ディスティングイッシュト・ヤングリサーチャーに選ばれました!
-
- 2023.3.28
- 花村准教授が医学部のベストティーチャー賞を受賞しました。おめでとうございます。
-
- 2022.12.1
- 医学部医学科4年生の勝部さんと中村くんが第96回日本薬理学会年会で発表しました。
-
- 2022.9.1
- 川辺さんが書いた記事が朝日新聞社の「論座」に掲載されました。
-
- 2022.7.23
- 川辺さんが日本医学会のシンポジウムで日本の医学研究の現状について発表しました。
-
- 2021.10.4
- 小金澤さんと花村さんの論文が受理されました。
-
- 2021.4.18
- 薬理学分野のウェブサイトを開設しました。
教室について
教授挨拶

みなさま、薬理学分野のホームページを見ていただき、どうもありがとうございます!2020年10月1日から新生薬理学分野がスタートしました。
近年、統合失調症や認知症または自閉症などに代表される精神神経疾患に罹患する患者数は年々増加しています。こうした精神神経疾患はどのように発症するのでしょう?その鍵となるのはシナプスの異常です。シナプスは複雑な脳神経ネットワーク内で情報が伝達される際の中継点です。シナプスを介した情報伝達の異常が精神神経疾患の発症につながると考えられています。 シナプスに注目してその発症機序を分子レベルで明らかにするために、生化学的手法とマウス遺伝学そして超解像イメージング技術を駆使して私たちは研究を進めています。
群馬大学医学部のキャンパスはとても素晴らしい環境にあります。東京からのアクセスが良く、なおかつ豊かな自然に囲まれたキャンパスで大都会のストレスを感じることなく研究生活をエンジョイできます。キャンパスからは赤城山と榛名山そして妙義山の雄大な姿を眺めることができ、これらの山が季節ごとにどのように姿を変えていくのかとても楽しみにしています。群馬大学はこれまで日本の神経科学研究をリードしてきた大学の一つです。超一流の神経科学研究を進めるのに必要な環境が整っている国内では稀な大学です。
これからは教室員全員が力を合わせて群馬大学の研究をさらに発展させるために一生懸命努力していきます。どうぞよろしくお願いします!
メンバー

教授
川辺浩志
常に高い志を持って研究に取り組み、次の世代の研究者を育てていきます!

准教授
花村健次
神経細胞の発達や機能発現のメカニズムを明らかにし、各種精神神経疾患の病態の理解や治療法の開発に繋げたいと考えています。

助教
六本木麗子
人間がどのように「空気を読み」、社会性を育んでいくのかーーその謎に脳科学で挑み、誰もが生きやすい社会の実現につなげることを目指しています。

助教
小金澤紀子
シナプスが生み出す記憶のしくみを紐解きたいと思っています。世界を驚かせる発見を目指して、日々楽しく研究しています。

秘書
礒野伴子
教室の皆さんが研究に専念できる環境を作れるように、心掛けていきたいと思います。

技術補佐員
宮川愛子
薬理学教室の研究を全力でサポートできるよう努めます。

技術補佐員
店網幸子
志は高く、薬理学教室の研究を全力でサポートします。

大学院生
山村真伊
来年論文が書けるように小さなことからコツコツと日々の成果を!

医学部生
瀬川万里
医師×神経科学者の二刀流を目指して頑張ります!
客員教授
関野祐子
非常勤講師
児島伸彦
非常勤講師
花村健次
非常勤講師
山崎博幸
学生の皆さんへ
1.これからの日本を担う若者のみなさんへのメッセージ
研究って楽しいですか?
先日、群馬大学の学生さんから「川辺さん、研究って楽しいですか?」と聞かれました。当然楽しいです!三度の飯より好きです。研究のどこがそんなに魅力的なのか知りたいですか?一言で言うと自分自身のオリジナルの世界を描けることです。
みなさんは研究に対して「難しいことをやっている」というイメージを持っているかもしれません。研究は必ずしも難しくないと私は思います。若いうちに研究の基礎能力を身につければ、研究を心の底から楽しめるようになります。そうなればもうこっちのものです。毎日が楽しくて仕方ありません。研究の基礎能力には二つあります。一つ目は、「しっかりとした実験能力」です。再現性のあるデータ(つまり何度実験しても同じ結果になること)が研究の大前提です。二つ目は「データを俯瞰的に見る能力」です。この能力には生物学の基礎知識が必要です。基礎知識なくして、どうして教科書を書き換えるデータであるかどうか判断できますか?
私は大学院のときに、恩師の高井義美先生に厳しいトレーニングを受けて、二つの基礎能力の重要性を、特に「しっかりとした実験能力」の重要性を勉強させてもらいました。そのおかげで自分自身の実験データをもとに研究を展開して、研究を心底楽しんできました。自分自身の実験データについて一度考え出すと、食事の時やトイレにいる時、または風呂に入っている時など、どんな時でも常に考えてしまいます。考え抜いて導き出した仮説を、次の日に実験で証明できたときの充実感は何物にもかえられません。証明できたモデルは世界の誰のものでもなく自分自身のオリジナルなのです!この瞬間、私が世界で一番なのです。これからの若いみんなにもこの興奮を味わってもらいたいと思っています。
どうしたら研究をもっと楽しめるのでしょう?
上で説明した二つの能力を身につけることです。一点目である「しっかりとした実験能力」とは、「プロトコール(実験手順)を自分の手で書き出し、それに忠実に実験をこなすこと」と言えます。実験手技が高いだけではだめです。「プロトコール(実験手順)を自分の手で書き出す」ためには、ある程度の経験と知識が必要です。この点は、研究のプロである研究室のスタッフと相談しながら自分で考える必要があります。そして、「それに忠実に実験をこなす」ためには、プロトコールに書いてある手順に沿って地道に実験を進める必要があります。「この実験ステップは本質的じゃないからいいや」と実験の手順を変える若者がいます。これでは再現性のあるデータは取れません。結果が出ていないのに、その実験ステップが本質的かどうかどうしてわかるのですか?とにかくプロトコールに忠実に実験をこなす必要があるのです。
二つ目の能力として「データを俯瞰的に見る能力」があります。これに関しては私自身が発展途上です。最新の論文ではなく、教科書に書いてあることを理解して、いつでも知識の引き出しから出せなくてはいけません。
私は基礎研究をすべきでしょうか?
一つでも良いから自分の生きてきた証を残したいとあなたが考えているなら、大学院の間だけでも基礎研究に集中してみてはどうでしょう?あなたが発表した論文はあなた自身の研究成果として永遠に残ります。基礎研究を続けるかどうかは学位を取ったときに決めればいいじゃないですか。大学院の間に一生懸命に実験した経験は人生の糧になるはずです。もしあなたが毎日ワクワクした人生を送りたいと考えているなら、基礎研究をすることを強くお勧めします。あなたにとって研究者ほど楽しい職業はないと思います。また、自分自身のオリジナルの人生を送りたいというあなたには、研究者という職業は最適です。
若いみなさんには、ぜひお願いしたいことがあります。一回しかない人生を悔いのないように生きてほしいということです。そのためにも同調圧力には絶対に負けないで自分が正しいと思う道に進んでください。SNSの発達で誰もが匿名で他人を無責任に批判してそれに意見を合わせる風潮があります。そんなくだらない雑音には惑わされないでください。自分の心の奥底にある気持ちを大切に一回しかない人生を充実したものにしてください。そして一度こうすると決めたら、数年間はそれに没頭してください。文字通り必死に取り組んでみてから生涯をそれに捧げるか決めてはどうでしょう。大学院教育の3、4年間という期間は、そのために最適の期間だと思います。
どの研究室の大学院に入学すれば良いですか?
是非、うちの研究室にきてください。私にはこれまで三人の最高の指導者に研究の基礎を教えてもらう幸運と、多様な大学院生を指導した経験があります。
最初の指導者である高井義美先生のご指導のもとで大学院を修了した後、私はドイツのマックスプランク研究所で博士研究員として神経科学研究を進めました。その時の指導者がNils Brose先生です。Brose先生は個々の研究員の自由な発想に任せて、個人の意見を尊重して研究を進める先生でした。Brose先生はとても寛容な先生でマックスプランク研究所で私が研究していた15年間の間、Brose先生が声を荒げて怒ることを一度も見たことがありませんでした。それでもBrose先生が強いリーダーシップで研究室をまとめて世界最先端の研究を展開していたのは先生の人徳によるものだと思います。人徳は一朝一夕に身につくものではありません。しかしBrose先生に指導してもらったからこそ、その重要性を意識しながら毎日過ごしています。
マックスプランク研究所での研究の後に、神戸大学と神戸医療産業都市推進機構に異動して研究を進めました。神戸医療産業都市推進機構の先端医療研究センターのセンター長である鍋島陽一先生には、研究の方向性についてたびたび相談に乗っていただきました。鍋島先生に「川辺さん、この研究はあなたが本当にやりたい研究ですか。」と質問されて、目がさめた気がしたのを覚えています。鍋島陽一先生からは「データを俯瞰的に見る能力」の重要性を教えていただきました。
ドイツのマックスプランク研究所ではグループリーダーとして個性的な大学院生を多く指導してきて、個人個人にあった教育・指導が必要であることを学んできました。若い研究者の指導に関しては百戦錬磨で、それぞれの才能を最大限に伸ばす指導力があると自負しています。
これまでお世話になった皆さんのおかげで研究者として成長できたと思います。本当に幸せな人生です。こうして得られた研究能力を次の世代に伝えることが私の使命の一つだと感じています。みなさんの研究者としての人生を充実したものにするためにも是非私たちの研究室で研究しましょう!興味のある方は教授の川辺までメールを送ってください。メールアドレスはkawabe(a)gunma-u.ac.jp ((a)を@に変えてください)です。
2. どうすれば薬理学分野に参加できるの?
私たちの研究室に参加するにはいくつかの方法があります。
- 群馬大学の昭和キャンパスの学生さんで私たちの研究に興味のある方は、講義・実習の後に気軽に実験室に来てください。医学部MD-PhDコースの学生さんも大歓迎です。このコースの学生さんが、今日も薬理学研究室で一生懸命研究に取り組んでいます。
- 大学院に入学希望の方は、修士課程か博士課程の大学院入試を受験してください。他学部や他大学または海外からの大学院生も大歓迎です。
- 薬理学分野の実験機器を使って研究してみたいという民間企業や他大学または研究所の方、研究生としての参加、大歓迎です。
3. 研究室メンバーの学生からのメッセージ

3年前期の選択基礎医学実習の時期から薬理学教室(旧神経薬理学教室)でお世話になっている瀬川万里です。私は編入学試験を経て群馬大学医学部に入学しましたが、それ以前にも神経生物学の研究に取り組んでいました。一旦研究の世界からは離れたものの、「経験を生かして二周目のキャンパスライフを有意義なものにしたい」という思いで、再び基礎研究の門を叩きました。幸い教室員の皆様にも快く受け入れて頂き、MD-PhDコースの学生として研究に参加しています。現在は多光子励起顕微鏡を用いて、生きたままのマウス脳内の神経細胞を観察するという、非常に魅力的な研究に取り組ませてもらっています。革新的な顕微鏡をはじめとする充実した研究設備にも恵まれており、世界に通用する研究に取り組めるチャンスが溢れています。神経科学や薬理学に興味のある人、将来的に博士課程進学を考えている人、何だかよくわからないけど研究の話を聞いてみたい人など、少しでも興味があれば、是非話を聞きに来てください。研究経験のない方ももちろん大歓迎です。一緒にワクワクする研究に挑戦しましょう!
研究について
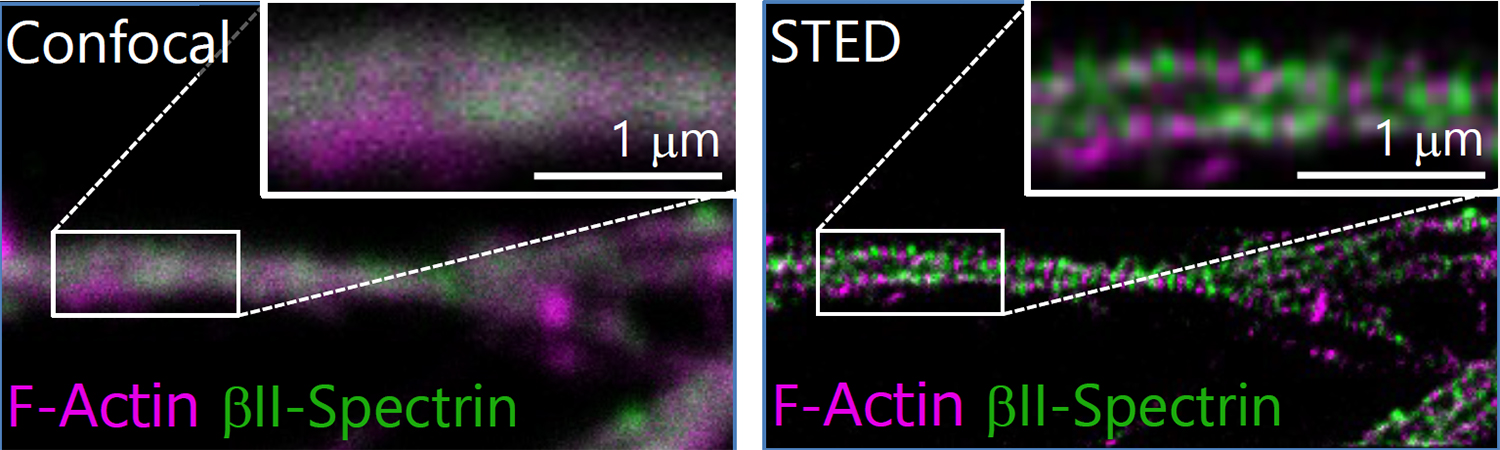
1. 超解像STED顕微鏡を使った技術開発と形態観察

一般に使われている蛍光顕微鏡であるコンフォーカル顕微鏡(左)と超解像STED顕微鏡(右)でシナプス構成タンパク質であるHomer1の局在を脳組織内で観察した結果です。右の図では小さな点が分布している様子がはっきりとわかります。実際の脳ではこのようにシナプスが分布しているのかと思うと感動すら覚えます。このように超解像STED顕微鏡を使うことでHomer1の局在を指標にしてシナプスの分布を正確に観察することができます。脳組織内で立体的にタンパク質の局在を正確に捉えることができる蛍光顕微鏡は国内では限られた数しかありません。私たちはこの超解像STED顕微鏡を運用しており、この解像度をさらに向上させる技術開発を行います。超解像STED顕微鏡を応用することで、脳内の未知の構造を発見していきます。
2. 精神神経疾患の病態の解明
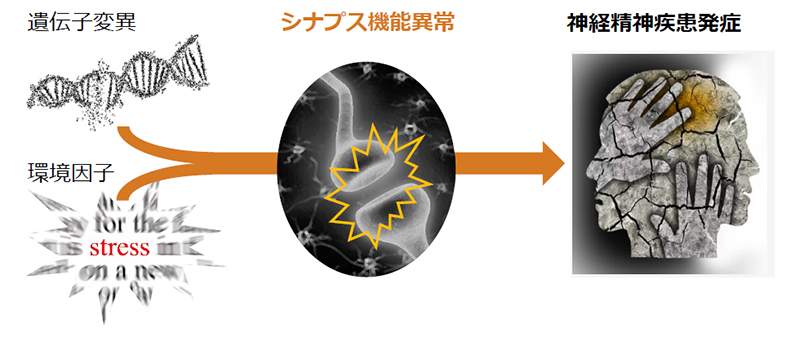
近年のゲノム医科学研究の成果から、いくつかの神経精神疾患が遺伝子変異によって引き起こされるのではないかと考えられています。また、ストレスなどの環境因子も神経精神疾患発症の一因になります。シナプスは複雑な脳神経ネットワーク内で情報が伝達される際の中継点ですが、シナプス構成タンパク質をコードする遺伝子の変異と環境因子がシナプス機能異常につながり、神経精神疾患を引き起こす可能性が考えられています。しかし、このモデルがどこまで正しいのかは不明です。
私たちはすでに神経精神疾患発症に関連する遺伝子の欠損マウスを複数作成しました。これらの遺伝子欠損マウスを解析して、シナプスレベルで神経精神疾患発症の分子機構を明らかにし、創薬につなげていきます。
3. タンパク質分解のシナプスでの制御機構と認知機能への影響の解明
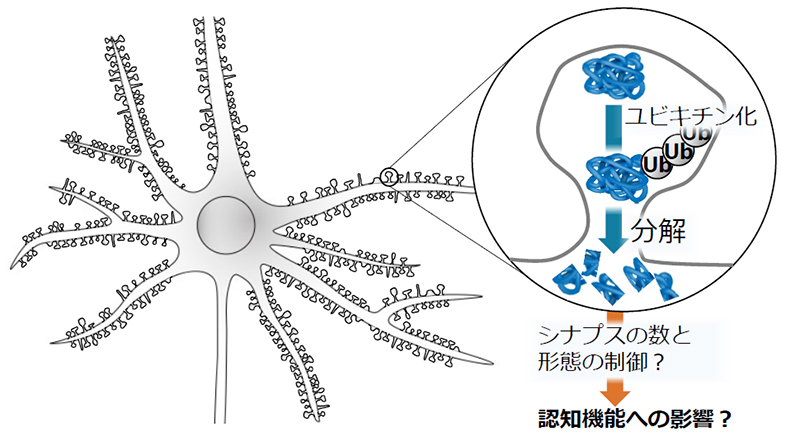
シナプスは数百種類のタンパク質から構成されており、シナプス構成タンパク質の多くはユビキチン化されて分解に導かれると考えられています。しかし、個々のタンパク質がシナプス内のどこでどのタイミングで分解されるのか十分に明らかになっていません。特定のタンパク質の分解がどのようにシナプスの数と形態を制御しているのか、そして、どのように認知機能に影響しているのかも不明です。私たちは超解像STED顕微鏡と生化学的手法を組み合わせてこれらを明らかにすることで、私たちの研究成果を認知機能改善につなげていきます。
研究内容についてもっと詳しく知りたい方は、川辺までご連絡ください。アドレスは、kawabe (a) gunma-u.ac.jp ((a)を@に変えてください)です。
これまでの海外の共同研究先
以下の海外の研究機関と共同研究を進めてきました。共同研究者は私にとって掛け替えのない友人であり、一緒に戦ってきた同志です。ヨーロッパ研究機関が多いですね。薬理学分野所属の学生・大学院生はこれらの研究機関に滞在して研究を進めることも可能です。
ドイツ
マックスプランク実験医学研究所、マックスプランク生物物理化学研究所、ベルリン・シャリテ医科大学、ゲッチンゲン大学、ハンブルグ・エッペンドルフ大学、リューベック大学、ライプチヒ大学、ウルム大学、アーヘン大学、マックスプランク免疫生物学・エピジェネティクス研究所、ライプニッツ研究所
スイス
チューリッヒ・ETH、ローザンヌ大学
フランス
パリ・ソルボンヌ大学
イギリス
ダンディー大学
スペイン
バルセロナ大学
ベルギー
リージュ大学
アメリカ
ハーバード大学、スタンフォード大学、トーマスジェファソン大学、メリーランド大学、ノースウェスタン大学、スクリプス研究所、ソーク研究所
カナダ
トロント大学、バンクーバー大学
オーストラリア
アデレード大学
ブラジル
サンパウロ大学
中国
南京大学、天津医科大学
シンガポール
シンガポール国立大学
業績
川辺教授のこれまでの業績
- Koganezawa N, Hanamura K, Krueger-Burg D, Kawabe H. (2021) Super-resolved 3D-STED microscopy identifies a layer-specific increase in excitatory synapses in the hippocampal CA1 region of Neuroligin-3 KO mice. Biochemical and Biophysical Research Communications 582:144-149.
- Kawabe H. Stegmüller J. (2021) The role of E3 ubiquitin ligases in synapse function in the healthy and diseased brain. Molecular and cellular neurosciences 112:103602-103602.
- Leitz D.H.W, Duerr J, Mulugeta S, Seyhan Agircan A, Zimmermann S, Kawabe H. Dalpke A.H, Beers M.F, Mall M.A.(2021) Congenital Deletion of Nedd4-2 in Lung Epithelial Cells Causes Progressive Alveolitis and Pulmonary Fibrosis in Neonatal Mice International Journal of Molecular Sciences 22(11): 6146-6146.
- Ambrozkiewicz MC*, Borisova E, Schwark M, Ripamonti S, Schaub T, Smorodchenko A, Weber AI, Rhee HJ, Altas B, Yilmaz R, Mueller S, Piepkorn L, Horan ST, Straussberg R, Zaqout S, Jahn O, Dere E, Rosário M, Boehm-Sturm P, Borck G, Willig K, Rhee JS, Tarabykin V, Kawabe H.* (2021) The murine ortholog of Kaufman oculocerebrofacial syndrome protein Ube3b regulates synapse number by ubiquitinating Ppp3cc. Molecular Psychiatry 26(6):1980-1995. *=Corresponding authors
- Akter N, Fukaya R, Adachi R, Kawabe H and Kuba H.(2020) Structural and Functional Refinement of the Axon Initial Segment in Avian Cochlear Nucleus during Development.Journal of Neuroscience 40 (35): 6709-6721.
- Hoshino S, Kobayashi M, Tagawa R, Konno R, Abe T, Furuya K, Miura K, Wakasawa H, Okita N, Sudo Y, Mizunoe Y, Nakagawa Y, Nakamura T, Kawabe H, Higami Y. (2020) WWP1 knockout mice have exacerbated obesity-related phenotype in white adipose tissue but improved whole body glucose metabolism. FEBS Open Bio 10:306-315.
- Luo L, Ambrozkiewicz MC, Benseler F, Chen C, Dumontier E, Falkner S, Furlanis E, Gomez AM, Hoshina N, Huang WH, M Hutchison MA, Itoh-Maruoka Y, Lavery LA, Li W, Maruo T, Motohashi J, Pai ELL, Pelkey KA, Pereira A, Philips T, Sinclair JL, Stogsdill JA, Traunmüller L, Wang J, Wortel J, You W, Abumaria N, Beier KT, Brose N, Burgess HA, Cepko CL, Cloutier JF, Eroglu C, Goebbels S, Kaeser PS, Kay JN, Lu W, Luo L, Mandai K, McBain CJ, Nave KA, Prado MAM, Prado VF, Rothstein J, Rubenstein JLR, Saher G, Sakimura K, Sanes JR, Scheiffele P, Takai Y, Umemori H, Verhage M, Yuzaki M, Zoghbi HY, Kawabe H*, Craig AM*. (2020) Optimizing nervous system-specific gene targeting with Cre driver lines: prevalence of germline recombination and influencing factors. Neuron 106:1–29. *=Corresponding authors
- Ambrozkiewicz M.C, Cuthill K.J, Harnett D, Kawabe H, Tarabykin V. (2020) Molecular Evolution, Neurodevelopmental Roles and Clinical Significance of HECT-Type UBE3 E3 Ubiquitin Ligases. Cells 9(11).
- Ding X, Jo J, Wang C.Y, Cristobal C.D, Zuo Z, Ye Q, Wirianto M, Lindeke-Myers A, Choi J.Mi, Mohila C.A, Kawabe H, Jung S.Y, Bellen H.J, Yoo S.H, Lee H.K. (2020) The Daam2-VHL-Nedd4 axis governs developmental and regenerative oligodendrocyte differentiation. Genes & development 34(17-18):1177-1189.
- Duerr J, Leitz D.H.W, Szczygiel M, Dvornikov D, Fraumann S.G, Kreutz C, Zadora P.K, Seyhan Agircan A, Konietzke P, Engelmann T.A, Hegermann J, Mulugeta S, Kawabe H, Knudsen L, Ochs M, Rotin D, Muley T, Kreuter M, Herth F.J.F, Wielpütz M.O, Beers M.F, Klingmüller U, Mall M.A. (2020) Conditional deletion of Nedd4-2 in lung epithelial cells causes progressive pulmonary fibrosis in adult mice. Nature communications 11(1):2012-2012.
- Ambrozkiewicz MC*, Schwark M, Kishimoto-Suga M, Borisova E, Hori K, Salazar-Lázaro A, Rusanova A, Altas B, Piepkorn L, Bessa P, Schaub T, Zhang X, Rabe T, Ripamonti S, Rosário M, Akiyama H, Jahn O, Kobayashi T, Hoshino M, Tarabykin V, Kawabe H*. (2018) Polarity acquisition in cortical neurons is driven by synergistic action of Sox9-regulated Wwp1 and Wwp2 E3 ubiquitin ligases and intronic miR-140. Neuron 100:1097-1115. *=Corresponding authors
- Ogawa M, Matsuda R, Tomokiyo M, Takada N, Yamamoto S, Shizukusihi S, Yamaji T, Yoshikawa Y, Yoshida M, Tanida I, Koike M, Murai M, Morita H, Takeyama H, Ryo A, Guan JL, Yamamoto M, Inoue JI, Yanagawa T, Fukuda M, Kawabe H, Ohnishi M. (2018) Molecular mechanisms of Streptococcus pneumoniae-targeted autophagy via pneumolysin, Golgi-resident Rab41, and Nedd4-1 mediated K63-linked ubiquitination. Cellular Microbiology 20:e12846.
- Bhouri M, Morishita W, Temkin P, Goswami D, Kawabe H, Brose N, Südhof TC, Craig AM, Siddiqui TJ, Malenka R. (2018) Deletion of LRRTM1 and LRRTM2 in adult mice impairs basal AMPA receptor transmission and LTP in hippocampal CA1 pyramidal neurons. Proc. Natl. Acad. Sci. USA. 115:E5382-E5389.
- Pei G, Buijze H, Liu H, Moura-Alves P, Goosmann C, Brinkmann V, Kawabe H, Dorhoi A, Kaufmann SHE. (2017) The E3 ubiquitin ligase NEDD4 enhances killing of membrane-perturbing intracellular bacteria by promoting autophagy. Autophagy 13:2041-2055.
- Henshall TL, Manning JA, Alfassy OS, Boase NA, Goel P, Kawabe H, Kumar S. (2017) Deletion of Nedd4-2 results in progressive kidney disease in mice. Cell Death Differ. 24:2150-2160.
- Lee JH, Jeon SA, Kim BG, Takeda M, Cho JJ, Kim DI, Kawabe H, Cho JY. (2017) Nedd4 deficiency in vascular smooth muscle promotes vascular calcification by stabilizing pSmad1. J. Bone Miner. Res. 32:927-938.
- Crosby JR, Zhao C, Jiang C, Bai D, Katz M, Greenlee S, Kawabe H, McCaleb M, Rotin D, Guo S, Monia BP. (2017) Inhaled ENaC antisense oligonucleotide ameliorates cystic fibrosis-like lung disease in mice. J. Cyst. Fibros. 16:671-680.
- Zhou Z, Kawabe H, Suzuki A, Shinmyozu K, Saga Y. (2017) NEDD4 controls spermatogonial stem cell homeostasis and stress response by regulating messenger ribonucleoprotein complexes. Nat. Commun. 8:15662.
- Sigler A, Oh WC, Imig C, Altas B, Kawabe H, Cooper BH, Kwon HB, Rhee JS, Brose N. (2017) Formation and maintenance of functional spines in the absence of presynaptic glutamate release. Neuron 94:304-311.
- Kawabe H, Mitkovski M, Kaeser PS, Hirrlinger J, Opazo F, Nestvogel D, Kalla S, Fejtova A, Verrier SE, Bungers SR, Cooper BH, Varoqueaux F, Wang Y, Nehring RB, Gundelfinger ED, Rosenmund C, Rizzoli SO, Südhof TC, Rhee JS, Brose N. (2017) ELKS1 localizes the synaptic vesicle priming protein bMunc13-2 to a specific subset of active zones. J. Cell Biol. 216:143-161.
- Jiang C, Kawabe H, Rotin D. (2017) The ubiquitin ligase Nedd4L regulates the Na/K/2Cl co-transporter NKCC1/SLC12A2 in the colon. J. Biol. Chem. 292:137-145.
- Ripamonti S, Ambrozkiewicz MC, Guzzi F, Gravati M, Biella G, Bormuth I, Hammer M, Tuffy LP, Sigler A, Kawabe H, Nishimori K, Toselli M, Brose N, Parenti M, Rhee JS. (2017) Transient oxytocin signaling primes the development and function of excitatory hippocampal neurons. elife 6:22466.
- Lu C, Thoeni C, Connor A, Kawabe H, Gallinger S, Rotin D. (2016) Intestinal knockout of Nedd4 enhances growth of Apcmin tumors. Oncogene 35: 5839- 5849.
- Canal M, Martín-Flores N, Pérez-Sisqués L, Romaní-Aumedes J, Altas B, Man HY, Kawabe H, Alberch J, Malagelada C. (2016) Loss of NEDD4 contributes to RTP801 elevation and neuron toxicity:implications for Parkinson’s disease. Oncotarget 7:58813-58831.
- Lipina TV, Prasad T, Yokomaku D, Luo L, Connor SA, Kawabe H, Wang YT, Brose N, Roder JC, Craig AM. (2016) Cognitive deficits in Calsyntenin-2-deficient mice associated with reduced GABAergic transmission. Neuropsychopharmacology 41:802-810.
- Ott C, Martens H, Hassouna I, Oliveira B, Erck C, Zafeiriou MP, Peteri UK, Hesse D, Gerhart S, Altas B, Kolbow T, Stadler H, Kawabe H, Zimmermann WH, Nave KA, Schulz-Schaeffer W, Jahn O, Ehrenreich H. (2015) Widespread expression of erythropoietin receptor in brain and its induction by injury. Mol. Med. 21:803-815.
- Hsia HE, Kumar R, Luca R, Takeda M, Courchet J, Nakashima J, Wu S, Goebbels S, An W, Eickholt B, Polleux F, Rotin D, Wu H, Rossner M, Bagni C, Rhee JS, Brose N, Kawabe H*. (2014) Ubiquitin E3 ligase Nedd4-1 acts as a downstream target of PI3K/PTEN-mTORC1 signaling to promote neurite growth. Proc. Natl. Acad. Sci. USA. 111:13205-13210. *=Corresponding author
- Pettem KL, Yokomaku D, Luo L, Linhoff MW, Prasad T, Connor SA, Siddiqui TJ, Kawabe H, Chen F, Zhang L, Rudenko G, Wang YT, Brose N, Craig AM. (2013) The specific α-Neurexin interactor Calsyntenin-3 promotes excitatory and inhibitory synapse development. Neuron 80:113-128.
- Siddiqui TJ, Tari PK, Conner SA, Zhang P, Dobie FA, She K, Kawabe H, Wang YT, Brose N, Craig AM. (2013) An LRRTM4-HSPG complex mediates excitatory synapse development on dentate gyrus granule cells. Neuron 79:680-695.
- Nagpal P, Plant PJ, Correa J, Bain A, Takeda M, Kawabe H, Rotin D, Bain JR, Batt JA. (2012) The ubiquitin ligase Nedd4-1 participates in denervation-induced skeletal muscle atrophy in mice. PLOS One 7:e46427.
- Cooper B, Hemmerlein M, Ammermüller J, Imig C, Reim K, Lipstein N, Kalla S, Kawabe H, Brose N, Brandstätter JH, Varoqueaux F. (2012) Munc13-independent vesicle priming at mouse photoreceptor ribbon synapses. J. Neurosci. 32:8040-8052.
- Kimura T*, Kawabe H*, Jiang C, Zhang W, Xiang YY, Lu C, Salter MW, Brose N, Lu WY, Rotin D. (2011) Deletion of the ubiquitin ligase Nedd4L in lung epithelia causes cystic fibrosis-like disease. Proc. Natl. Acad. Sci. USA. 108:3216-3221. *=Equal contribution
- Kawabe H*, Neeb A, Dimova K, Young SM Jr, Takeda M, Katsurabayashi S, Mitkovski M, Malakhova OA, Zhang DE, Umikawa M, Kariya K, Goebbels S, Nave KA, Rosenmund C, Jahn O, Rhee JS, Brose N*. (2010) Regulation of Rap2A by the ubiquitin ligase Nedd4-1 controls neurite development. Neuron 65:358-372. *=Corresponding authors
- Fouladkou F, Lu C, Jiang C, Zhou L, She Y, Walls JR, Kawabe H, Brose N, Henkelman RM, Huang A, Bruneau BG, Rotin D. (2010) The ubiquitin ligase NEDD4-1 is required for heart development and is a suppressor of thrombospondin-1. J. Biol. Chem. 285:6770-6780.
- Gómez-Varela D, Kohl T, Schmidt M, Rubio ME, Kawabe H, Nehring RB, Schäfer S, Stühmer W, Pardo LA. (2010) Characterization of Eag1 channel lateral mobility in rat hippocampal cultures by single-particle-tracking with quantum dots. PLOS One 5:e8858.
- Trimbuch T, Beed P, Vogt J, Schuchmann S, Maier N, Kintscher M, Breustedt J, Schuelke M, Streu N, Kieselmann O, Brunk I, Laube G, Strauss U, Battefeld A, Wende H, Birchmeier C, Wiese S, Sendtner M, Kawabe H, Kishimoto-Suga M, Brose N, Baumgart J, Geist B, Aoki J, Savaskan NE, Bräuer AU, Chun J, Ninnemann O, Schmitz D, Nitsch R. (2009) Synaptic PRG-1 modulates excitatory transmission via lipid phosphate-mediated signaling. Cell 138:1222-1235.
- Fouladkou F, Landry T, Kawabe H, Neeb A, Lu C, Brose N, Stambolic V, Rotin D. (2008) The ubiquitin ligase Nedd4-1 is dispensable for the regulation of PTEN stability and localization. Proc. Natl. Acad. Sci. USA. 105:8585-8590.
- Dimova K*, Kawabe H*, Betz A, Brose N, Jahn O. (2006) Characterization of the Munc13-calmodulin interaction by photoaffinity labeling. Biochim. Biophys. Acta Mol. Cell Res. 1763:1256-1265. *=Equal contribution
- Andrews-Zwilling YS, Kawabe H, Reim K, Varoqueaux F, Brose N. (2006) Binding to Rab3A-interacting molecule RIM regulates the presynaptic recruitment of Munc13-1 and ubMunc13-2. J. Biol. Chem. 281:19720-19731.
- Kawabe H, Sakisaka T, Yasumi M, Shingai T, Izumi G, Nagano F, Deguchi-Tawarada M, Takeuchi M, Nakanishi H, Takai Y. (2003) A novel rabconnectin-3-binding protein that directly binds a GDP/GTP exchange protein for Rab3A small G protein implicated in Ca2+-dependent exocytosis of neurotransmitter. Genes Cells 8:537-546.
- Nagano F*, Kawabe H*, Nakanishi H, Shinohara M, Deguchi-Tawarada M, Takeuchi M, Sasaki T, Takai Y. (2002) Rabconnectin-3, a novel protein that binds both GDP/GTP exchange protein and GTPase-activating protein for Rab3 small G protein family. J. Biol. Chem. 277:629-632. *=Equal contribution
- Kawabe H, Nakanishi H, Asada M, Fukuhara A, Morimoto K, Takeuchi M, Takai Y. (2001) Pilt, a novel peripheral membrane protein at tight junctions in epithelial cells. J. Biol. Chem. 276:48350-48355.
- Deguchi M, Iizuka T, Hata Y, Nishimura W, Hirao K, Yao I, Kawabe H, Takai Y. (2000) PAPIN. A novel multiple PSD-95/Dlg-A/ZO-1 protein interacting with neural plakophilin-related armadillo repeat protein/delta-catenin and p0071. J. Biol. Chem. 275:29875-29880.
- Kikyo M, Matozaki T, Kodama A, Kawabe H, Nakanishi H, Takai Y. (2000) Cell-cell adhesion-mediated tyrosine phosphorylation of nectin-2delta, an immunoglobulin-like cell adhesion molecule at adherens junctions. Oncogene 19:4022-4028.
- Yao I, Ohtsuka T, Kawabe H, Matsuura Y, Takai Y, Hata Y. (2000) Association of membrane-associated guanylate kinase-interacting protein-1 with Raf-1. Biochem. Biophys. Res. Commun. 270:538-542.
- Hirao K, Hata Y, Deguchi M, Yao I, Ogura M, Rokukawa C, Kawabe H, Mizoguchi A, Takai Y. (2000) Association of synapse-associated protein 90/ postsynaptic density-95-associated protein (SAPAP) with neurofilaments. Genes Cells 5:203-210.
- Hirao K, Hata Y, Yao I, Deguchi M, Kawabe H, Mizoguchi A, Takai Y. (2000) Three isoforms of synaptic scaffolding molecule and their characterization: multimerization between the isoforms and their interaction with N-methyl-D-aspartate receptors and SAP90/PSD-95-associated protein. J. Biol. Chem. 275:2966-2972.
- Kawabe H, Hata Y, Takeuchi M, Ide N, Mizoguchi A, Takai Y. (1999) nArgBP2, a novel neural member of ponsin/ArgBP2/vinexin family that interacts with synapse-associated protein 90/postsynaptic density-95-associated protein (SAPAP). J. Biol. Chem. 274:30914-30918.
- Shimizu K, Kawabe H, Minami S, Honda T, Takaishi K, Shirataki H, Takai Y. (1996) SMAP, an Smg GDS-associating protein having arm repeats and phosphorylated by Src tyrosine kinase. J. Biol. Chem. 271:27013-27017.
旧神経薬理学分野の業績
- Yin XL, Jia QF, Zhang GY, Zhang JP, Shirao T, Jiang CX, Yin XY, Liu YS, Chen P, Gu XC, Qian ZK, Yin GZ, Sen Xia H, Hui L. (2019) Association between decreased serum TBIL concentration and immediate memory impairment in schizophrenia patients. Sci. Rep. 9:1622.
- Miki D, Kobayashi Y, Okada T, Miyamoto T, Takei N, Sekino Y, Koganezawa N, Shirao T, Saito Y. (2019) Characterization of functional primary cilia in human induced pluripotent stem cell-derived neurons. Neurochem. Res. 44:1736-1744.
- Mitsuoka T, Hanamura K, Koganezawa N, Kikura-Hanajiri R, Sekino Y, Shirao T. (2019) Assessment of NMDA receptor inhibition of phencyclidine analogues using a high-throughput drebrin immunocytochemical assay. J. Pharmacol. Toxicol. Methods. 106583
- Hanamura K, Koganezawa N, Kamiyama K, Tanaka N, Oka T, Yamamura M, Sekino Y, Shirao T. (2019) High-content imaging analysis for detecting the loss of drebrin clusters along dendrites in cultured hippocampal neurons. J. Pharmacol. Toxicol. Methods. 106607.
- Puspitasari A, Yamazaki H, Kawamura H, Nakano T, Takahashi A, Shirao T, Held KD. (2019) X-irradiation of developing hippocampal neurons causes changes in neuron population phenotypes, dendritic morphology and synaptic protein expression in surviving neurons at maturity. Neurosci. Res. S0168-0102: 30320-7.
- Miao S, Koganezawa N, Hanamura K, Puspitasari A, Shirao T. (2018) N-methyl-D-aspartate receptor mediates X-irradiation-induced drebrin decrease in hippocampus. Kitakanto Medical Journal 68: 111-115
- Hanamura K, Kamata Y, Yamazaki H, Kojima N, Shirao T. (2018) Isoform-dependent regulation of drebrin dynamics in dendritic spines. Neuroscience 379: 67–76
- Yamazaki H, Sasagawa Y, Yamamoto H, Bito H, Shirao T. (2018) CaMKIIβ is localized in dendritic spines as both drebrin-dependent and drebrin-independent pools. J. Neurochem. 146:145-159.
- Yasuda H, Kojima N, Yamazaki H, Hanamura K, Sakimura K, Shirao T. (2018) Drebrin isoforms critically regulate NMDAR- and mGluR-dependent LTD induction. Front. Cell. Neurosci. 12:330.
- 小金澤紀子、花村健次、白尾智明 (2017) 「ヒトiPS細胞由来神経細胞を用いた医薬品評価系の現状について」日本薬理学雑誌 149: 104-109
- Shirao T, Hanamura K, Koganezawa N, Ishizuka Y, Yamazaki H, Sekino Y. (2017) The role of drebrin in neurons. J. Neurochem. 141:819-834.
- Koganezawa N, Hanamura K, Sekino Y, Shirao T. (2017) The role of drebrin in dendritic spines. Mol. Cell. Neurosci. 84:85-92.
- Li B, Ding S, Feng N, Mooney N, Ooi YS, Renf L, Diep J, Kelly MR, Yasukawa LL, Patton JT, Yamazaki H, Shirao T, Jackson PK, Greenberg HB. (2017) Drebrin restricts rotavirus entry by inhibiting dynamin-mediated endocytosis. Proc. Natl. Acad. Sci. USA. 114:E3642-E3651.
- Kajita Y, Kojima N, Koganezawa N, Yamazaki H, Sakimura K, Shirao T. (2017) Drebrin E regulates neuroblast proliferation and chain migration in the adult brain. Eur. J. Neurosci. 46:2214-2228.
- Hanamura K, Washburn HR, Sheffler-Collins SI, Xia NL, Henderson N, Tillu DV, Hassler S, Spellman DS, Zhang G, Neubert TA, Price TJ, Dalva MB. (2017) Extracellular phosphorylation of a receptor tyrosine kinase controls synaptic localization of NMDA receptors and regulates pathological pain. PLoS Biol. 15:e2002457.
- Shirao T, Sekino Y. (Eds.) (2017) Drebrin. (Advances in Experimental Medicine and Biology, vol 1006) Tokyo, Springer
- Sekino Y, Koganezawa N, Mizui T, Shirao T. (2017) Role of Drebrin in Synaptic Plasticity. Adv. Exp. Med. Biol. 1006:183-201.
- Yamazaki H, Shirao T. (2017) Homer, Spikar, and Other Drebrin-Binding Proteins in the Brain. Adv. Exp. Med. Biol. 1006:249-268.
- Shirao T, Koganezawa N, Yamazaki H, Hanamura K, Imamura K. (2017) Localization of Drebrin: Light Microscopy Study. Adv. Exp. Med. Biol. 1006:105-118.
- Shirao T, Sekino Y. (2017) General Introduction to Drebrin. Adv. Exp. Med. Biol. 1006:3-22.
- Ishizuka Y, Hanamura K. (2017) Drebrin in Alzheimer’s Disease. Adv. Exp. Med. Biol. 1006:203-223.
- Hanamura K. (2017) Drebrin in Neuronal Migration and Axonal Growth. Adv. Exp. Med. Biol. 1006:141-155.
- Puspitasari A, Koganezawa N, Ishizuka Y, Kojima N, Tanaka N, Nakano T, Shirao T. (2016) X Irradiation Induces Acute Cognitive Decline via Transient Synaptic
- Dysfunction. Radiat. Res. 185:423-30.
- Fujieda T, Koganezawa N, Ide Y, Shirao T, Sekino Y. (2015) An Inhibitory Pathway Controlling the Gating Mechanism of the Mouse Lateral Amygdala Revealed by Voltage-Sensitive Dye Imaging. Neuroscience Letters 590:126-131.
- Xu S, Buraschi S, Morcavallo A, Genua M, Shirao T, Peiper SC, Gomella LG, Birbe R, Belfiore A, Iozzo RV, Morrione A. (2015) A novel role for drebrin in regulating progranulin bioactivity in urothelial cancer. Oncotarget 6:10825-39.
- Ishizuka Y, Shimizu H, Takagi E, Kato M, Yamagata H, Mikuni M, Shirao T. (2014) Histone deacetylase mediates the decrease in drebrin cluster density induced by amyloid beta oligomers. Neurochem. Int. 76:114-121.
- Tanabe K, Yamazaki H, Inaguma Y, Asada A, Kimura T, Takahashi J, Taoka M, Ohshima T, Furuichi T, Isobe T, Nagata K, Shirao T, Hisanaga S. (2014) Phosphorylation of drebrin by cyclin-dependent kinase 5 and its role in neuronal migration. PLOS One 9:e92291.
- Ishikawa M, Shiota J, Ishibashi1 Y, Hakamata T, Shoji S, Fukuchi M, Masaaki Tsuda M, Shirao T, Sekino Y, Baraban JM, Tabuchi A. (2014) Cellular localization and dendritic function of rat isoforms of the SRF coactivator MKL1 in cortical neurons. NeuroReport 25:585-592.
- Mizui T,Sekino Y, Yamazaki H, Ishizuka Y, Takahashi H, Kojima N, Kojima M, Shirao T. (2014) Myosin Ⅱ ATPase activity mediates the long-term potentiation-induced exodus of stable F-actin bound by drebrin A from dendritic spines. PLOS One 9: e85367.
- Yamazaki H, Kojima N, Kato K, Hirose H, Iwasaki T, Mizui T, Takahashi H, Hanamura K, Roppongi RT, Koibuchi N, Sekino Y, Mori N, Shirao T. (2013) Spikar, a novel drebrin-binding protein, regulates the formation and stabilization of dendritic spines. J. Neurochem. 128:507-522.
- 白尾智明、山崎博幸 (2013)「樹状突起棘(スパイン)のアクチンフィラメントと微小管」 Clinical Neuroscience 31: 1302-1395.
- Ishikawa M, Shiota J, Ishibashi Y, Hakamata T, Shoji S, Fukuchi M, Tsuda M, Shirao T, Sekino Y, Ohtsuka T, Baraban JM, Tabuchi A. (2013) Identification, expression and characterization of rat isoforms of the SRF coactivator MKL1. FEBS Open Bio. 3:387-393.
- Ishizuka Y, Kakiya N, Witters LA, Oshiro N, Shirao T, Nawa H, Takei N. (2013) AMP-activated protein kinase (AMPK) counteractsbrain-derived neurotrophic factor (BDNF)-induced mammalian target of rapamycin complex 1 (mTORC1) signaling in neurons. J. Neurochem. 127:66-77.
- Shirao T, Gonzalez-Billault C. (2013) Actin filaments and microtubules in dendritic spines. J. Neurochem. 126:155-164.
- Roppongi RT, Kojima N, Hanamura K, Yamazaki H, Shirao T. (2013) Selective reduction of drebrin and actin in dendritic spines of hippocampal neurons by activation of 5-HT2A receptors. Neurosci. Lett. 547:76-81.
- Shirai K, Mizui T, Suzuki Y, Okamoto M, Hanamura K, Yoshida Y, Hino M, Noda S, AL-Jahdari WS, Chakravarti A, Shirao T, Nakano T. (2012) X-Irradiation Changes Dendritic Spine Morphology and Density through Reduction of Cytoskeletal Proteins in Mature Neurons. Radiation Research 179:630-636.
- Canto CB, Koganezawa N, Beed P, Moser EI, Witter MP. (2012) All layers of medial entorhinal cortex receive presubicular and parasubicular inputs. J. Neurosci. 32: 17620-17631.
- Kato K, Shirao T, Yamazaki H, Imamura K, Sekino Y. (2012) Regulation of AMPA receptor recruitment by the actin binding protein drebrin in cultured hippocampal neurons. J. Neurosci. Neuroeng. 1: 153-160.
- Tanaka K, Sato K, Yoshida T, Fukuda T, Hanamura K, Kojima N, Shirao T, Yanagawa T, and Watanabe H. (2011) Evidence for cell density affecting C2C12 myogenesis: possible regulation of myogenesis by cell-cell communication. Muscle and Nerve 44:968-977.
- Kobayashi-Yamazaki C, Shirao T, Sasagawa Y, Maruyama Y, Akita H, Saji M, Sekino Y. (2011) Lesions of the supramammillary nucleus decrease self-grooming behavior of rats placed in an open field The Kitakanto Medical Jorunal 61:287-292.
- Han W, Takamatsu Y, Yamamoto H, Kasai S, Endo S, Shirao T, Kojima N, Ikeda K. (2011) Inhibitory role of inducible cAMP early repressor (ICER) in methamphetamine-induced locomotor sensitization. PLOS One 6:e21637.
- Okamoto T, Endo S, Shirao T, Nagao S. (2011) Role of Cerebellar Cortical Protein Synthesis in Transfer of Memory Trace of Cerebellum-Dependent Motor Learning. J. Neurosci. 31:8958-66.
- Kambe T, Motoi Y, Inoue R, Kojima N, Tada N, Kimura T, Sahara N, Yamashita S, Mizoroki T, Takashima A, Shimada K, Ishiguro K, Mizuma H, Onoe H, Mizuno Y, Hattori N. (2011) Differential regional distribution of phosphorylated tau and synapse loss in the nucleus accumbens in tauopathy model mice. Neurobiol. Dis. 42:404-414.
- Kaminuma T, Suzuki Y, Shirai K, Mizui T, Noda S, Yosida Y, Funayama T, Takahasi T, Kobayashi Y, Shirao T, Nakano T. (2010) Effectiveness of carbon-ion beams for apoptosis induction in rat primary immature hippocampal neurons. J. Rad. Res. 51:627-631.
- Hanamura K, Mizui T, Kakizaki T, Roppongi TR, Yamazaki H, Yanagawa Y, Shirao T (2010) Low accumulation of drebrin at glutamatergic postsynaptic sites on GABAergic neurons. Neuroscience 169:1489-1500.
- Perez-Martinez M, Gordon-Alonso M, Cabrero JR, Barrero-Villar M, Rey M, Mittelbrunn M, Lamana A, Morlino G, Calabia C, Yamazaki H, Shirao T, Vazquez J, Gonzalez-Amaro R, Veiga E, Sanchez-Madrid F. (2010) F-actin-binding protein drebrin regulates CXCR4 recruitment to the immune synapse. J. Cell Sci. 123:1160-1170.
- Mercer JC, Mottram LF Qi Q, Lee YC, Bruce D, Iyer A, Yamazaki H, Shirao T, Choe MH, Peterson BR, August A. (2010) Chemico-Genetic Identification of Drebrin as a Regulator of Calcium Responses. Int. J. Biochem. Cell Biol. 42:337-345.
- Kojima N, Hanamura K, Yamazaki H, Ikeda T, Itohara S, Shirao T. (2010) Genetic disruption of the alternative splicing of drebrin gene impairs context-dependent fear learning in adulthood. Neuroscience 165: 138-150.
- Okamoto M, Suzuki Y, Shirai K, Mizui T, Yoshida Y, Noda S, Al-Jahdari WS, Shirao T, Nakano T. (2009) Effect of Irradiation on the Development of Immature Hippocampal Neurons In Vitro. Radiat. Res. 172:718-724.
- Aoki C, Kojima N, Sabaliauskas N, Shah L, Oakford J, Ahmed T, Yamazaki H, Hanamura K, Shirao T. (2009) Drebrin A Knock-Out Eliminates the Rapid Form of Homeostatic Synaptic Plasticity at Excitatory Synapses of Intact Adult Cerebral Cortex. J. Comp. Neurol. 517:105-121.
- Ito M, Shirao T, Doya K, Sekino Y. (2009) Three-dimensional distribution of Fos-positive neurons in the supramammillary nucleus of the rat exposed to novel environment. Neurosci. Res. 64:397-402.
- Mizui T, Kojima N, Yamazaki H, Katayama M, Hanamura K, Shirao T. (2009) Drebrin E is involved in the mechanism regulating axonal growth through actin-myosin interactions. J. Neurochem. 109:611-622.
- Takahashi T, Yamazaki H, Hanamura K, Sekino Y, Shirao T. (2009) AMPA receptor inhibition causes abnormal dendritic spines by destabilizing drebrin. J. Cell. Sci. 122:1211-1229.
- Ivanov A, Esclapez M, Pellegrino1 C, Shirao T, Ferhat L. (2009) Drebrin A regulates the dendritic spine plasticity and synaptic function in cultured hippocampal neurons. J. Cell. Sci. 122: 524-534.
- Kojima N, Borlikova G, Sakamoto T, Yamada K, Ikeda T, Itohara S, Niki H, Endo S. (2008) Inducible cAMP early repressor acts as a negative regulator for kindling epileptogenesis and long-term fear memory. J. Neurosci. 28:6459-6472.
- Song M, Kojima N, Hanamura K, Sekino Y, Inoue KH, Mikuni M, Shirao T. (2008) Expression of drebrin E in migrating neuroblasts in adult rat brain: coincidence between drebrin E disappearance from cell body and cessation of migration. Neuroscience 152:670-682.
- Kobayashi C, Aoki C, Kojima N, Yamazaki H, Shirao T. (2007) Drebrin A content correlates with spine head size in the adult mouse cerebral cortex. J. Comp. Neurol. 503:618-26.
- Sekino Y, Kojima N, Shirao T. (2007) Role of actin cytoskeleton in dendritic spine morphogenesis. Neurochem. Int. 51:92-104.
- Kato K, Sekino Y, Takahashi H, Yasuda H, Shirao T. (2007) Increase of AMPA receptors-mediated miniature EPSC amplitude after chronic NMDA receptor blockade in cultured hippocampal neurons. Neurosci. Lett. 418: 4-8.
- Kojima N, Shirao T. (2007) Synaptic dysfunction and disruption of the postsynaptic drebrin-actin complex: the study of neurological disorders accompanied by cognitive deficits. Neurosci. Res. 58: 1-5.
- Majoul I, Shirao T, Sekino Y, Duden R. (2007) Many faces of Drebrin: from building dendritic spines and stabilizing gap junctions to shaping neurite-like cell processes. Histochem. Cell. Biol. 127: 355-361.
- Shirai K, Mizui T, Suzuki Y, Kobayashi Y, Nakano T, Shirao T. (2006) Differential effects of x-irradiation on immature and mature hippocampal neurons in vitro. Neurosci. Lett. 399: 57-60.
- Chang EH, Savage MJ, Flood DG, Thomas JM, Levy RB, Mahadomrongkul V, Shirao T, Aoki C, Huerta PT. (2006) AMPA receptor downscaling at the onset of Alzheimer’s pathology in double knock-in mice. Proc. Natl. Acad. Sci. USA. 103: 3410-3415.
- Fujisawa S, Shirao T, Aoki C. (2006) In vivo, competitive blockade of NMDA receptors induces rapid shape change of post-synaptic spines and F-actin reorganization within dendritic spines of adult rat cortex. Neuroscience 140:1177-1187.
- Takahashi H, Mizui T, Shirao T. (2006) Downregulation of drebrin A expression suppresses synaptic targeting of NMDA receptors in developing hippocampal neurons. J. Neuochem. 97(s1):110-115.
- Sekino Y, Tanaka S, Hanamura K, Yamazaki H, Sasagawa Y, Xue Y, Hayashi K, Shirao T. (2006) Activation of N-methyl-D-aspartate receptor induces a shift of drebrin distribution: disappearance from dendritic spines and appearance in dendritic shafts. Mol. Cell. Neurosci. 31: 493-504.
- Mahadomrongkul V, Huerta PT, Shirao T, Aoki C. (2005) Stability of the distribution of spines containing drebrin A in the sensory cortex layer I of mice expressing mutated APP and PS1 genes. Brain Res. 1064: 66-74.
- Mizui T, Takahashi H, Sekino Y, Shirao T. (2005) Overexpression of drebrin A in immature neurons induces the accumulation of F-actin and PSD-95 into dendritic filopodia, and the formation of large abnormal protrusions. Mol. Cell. Neurosci. 30: 149-157.
- Aoki C, Sekino Y, Hanamura K, Fujisawa S, Mahadomrongkul V, Ren Y, Shirao T. (2005) Drebrin A is a Postsynaptic Protein that Localizes in vivo to the Submembranous Surface of Dendritic Sites Forming Excitatory Synapses. J. Comp. Neurol. 483:383-402.
- 旧神経薬理学分野のリンク:http://neuro.dept.med.gunma-u.ac.jp/?page_id=96